蘭大二院焦作義團隊在胃癌治療靶點與天然藥物研發(fā)領(lǐng)域取得重要進(jìn)展
胃癌是我國最常見的消化系統(tǒng)的惡性腫瘤之一,嚴(yán)重影響人民健康。目前,由于胃癌的腫瘤異質(zhì)性和化療藥物的耐藥等問題,進(jìn)展期胃癌綜合治療效果欠佳,因而開發(fā)新型胃癌治療藥物意義重大。近兩年,蘭州大學(xué)第二醫(yī)院焦作義團隊從胃癌治療的臨床問題出發(fā),通過胃癌治療靶點篩選、臨床大樣本驗證,分子機制深入挖掘、靶向天然藥物篩選和胃癌人源化模型建立,在胃癌發(fā)病和靶向藥物耐藥機制以及天然靶向藥物開發(fā)等領(lǐng)域取得重要進(jìn)展。
?近日,焦作義團隊在胃癌靶向藥赫賽汀的耐藥機制及其增敏劑的開發(fā)方面取得成果。該團隊研究發(fā)現(xiàn),HER2下游存在一條新的信號通路HER2/SHC1/SHCBP1/PLK1,該信號通路的異常激活與赫賽汀耐藥密切相關(guān)。并據(jù)此篩選發(fā)現(xiàn)了新型的SHCBP1-PLK1復(fù)合體的抑制劑茶黃素-3, 3’-雙沒食子酸(TFBG),TFBG可顯著增敏赫賽汀治療胃癌的療效。該項研究成果揭示了HER2調(diào)控腫瘤生長的新機制,為研發(fā)赫賽汀臨床增敏劑提供了新思路。上述成果以題為“Hyperactivation of HER2-SHCBP1-PLK1 axis promotes tumor cell mitosis and impairs trastuzumab sensitivity to gastric cancer”發(fā)表于Nature Communications,焦作義和孫輝教授為共同通訊作者,萃英生物醫(yī)學(xué)研究中心博士后石文貴、博士研究生張耕源為共同第一作者。

原文連接:?https://www.nature.com/articles/s41467-021-23053-8
此外,焦作義團隊還針對Wnt/β-catenin信號通路異常的胃癌患者,在新治療靶點和靶向天然藥物開發(fā)方面取得了重要進(jìn)展,該成果闡明了β-catenin破壞復(fù)合物關(guān)鍵蛋白RACK1在胃癌中缺失的上游泛素化調(diào)控機制,發(fā)現(xiàn)泛素結(jié)合酶UBE2T作為治療胃癌的有效靶點,在調(diào)控Wnt/β-catenin信號通路中發(fā)揮著重要作用。更值得關(guān)注的是該團隊基于有效靶點UBE2T進(jìn)一步研發(fā)了有效治療胃癌的天然藥物柴胡皂苷,為Wnt/β-catenin信號通路異常激活的胃癌患者靶向藥物開辟了新前景。近期相關(guān)研究成果以“A novel UBE2T inhibitor suppresses Wnt/β-catenin signaling hyperactivation and gastric cancer progression by blocking RACK1 ubiquitination”為題發(fā)表于Nature子刊Oncogene,焦作義和孫輝教授為共同通訊作者,博士研究生俞澤元為第一作者。

原文連接:https://www.nature.com/articles/s41388-020-01572-w
上述成果均以蘭州大學(xué)為唯一單位,在國家自然基金項目及甘肅省重點研發(fā)計劃等項目支持下完成。這兩項研究從目前臨床上胃癌治療存在的問題出發(fā),在胃癌治療的新靶點及天然藥物的研發(fā)方面取得了重要進(jìn)展。該成果在線發(fā)表后,引起了國內(nèi)外腫瘤學(xué)界和生物醫(yī)藥行業(yè)的高度關(guān)注和廣泛興趣,為胃癌臨床靶向治療提供了新思路,也對中藥單體天然藥物研發(fā)產(chǎn)生了有力推動作用。
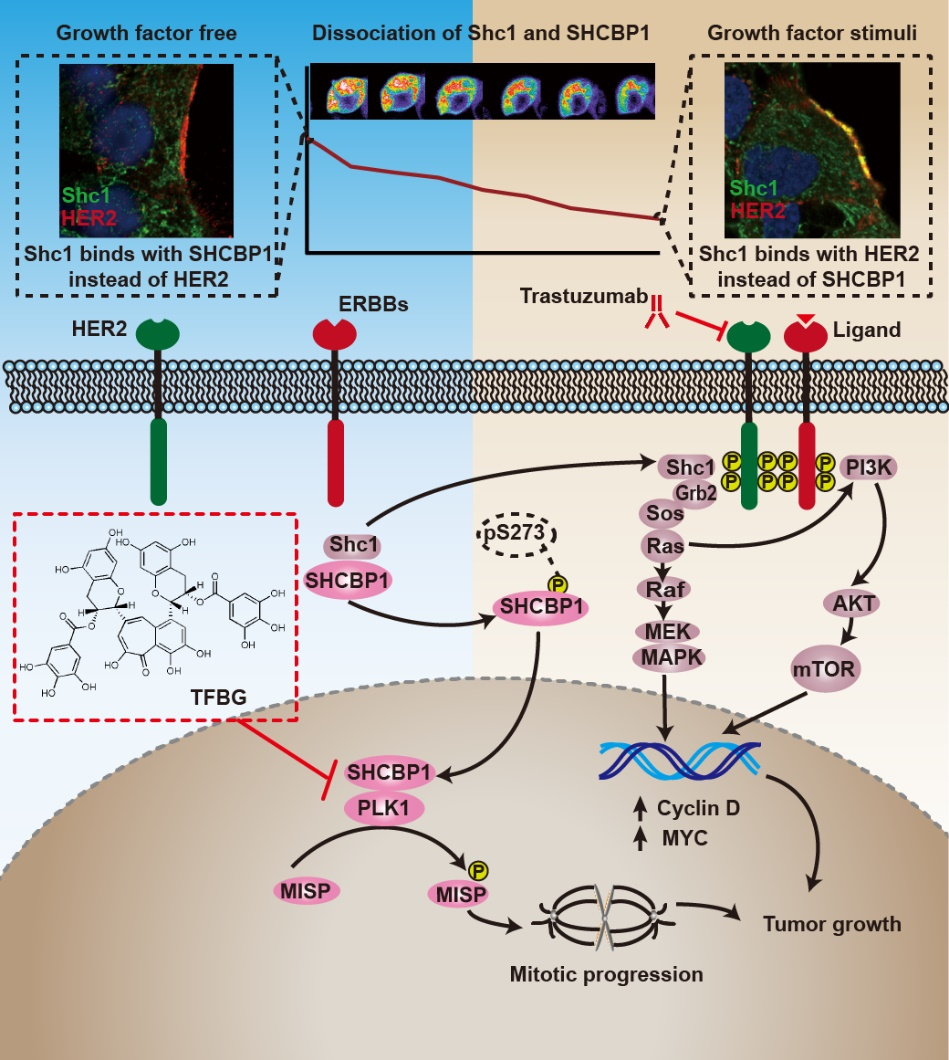
圖1. 該研究發(fā)現(xiàn)胃癌治療靶點HER2下游存在一條新的信號通路HER2/SHC1/SHCBP1/PLK1,該信號通路的異常激活與胃癌靶向藥赫賽汀的耐藥密切相關(guān)。茶黃素-3, 3’-雙沒食子酸(TFBG)是SHCBP1-PLK1復(fù)合體抑制劑,其與胃癌靶向藥物赫賽汀聯(lián)用,表現(xiàn)出優(yōu)異的抗HER2陽性胃癌的療效(Shi?et?al.?Nature?Communications)。
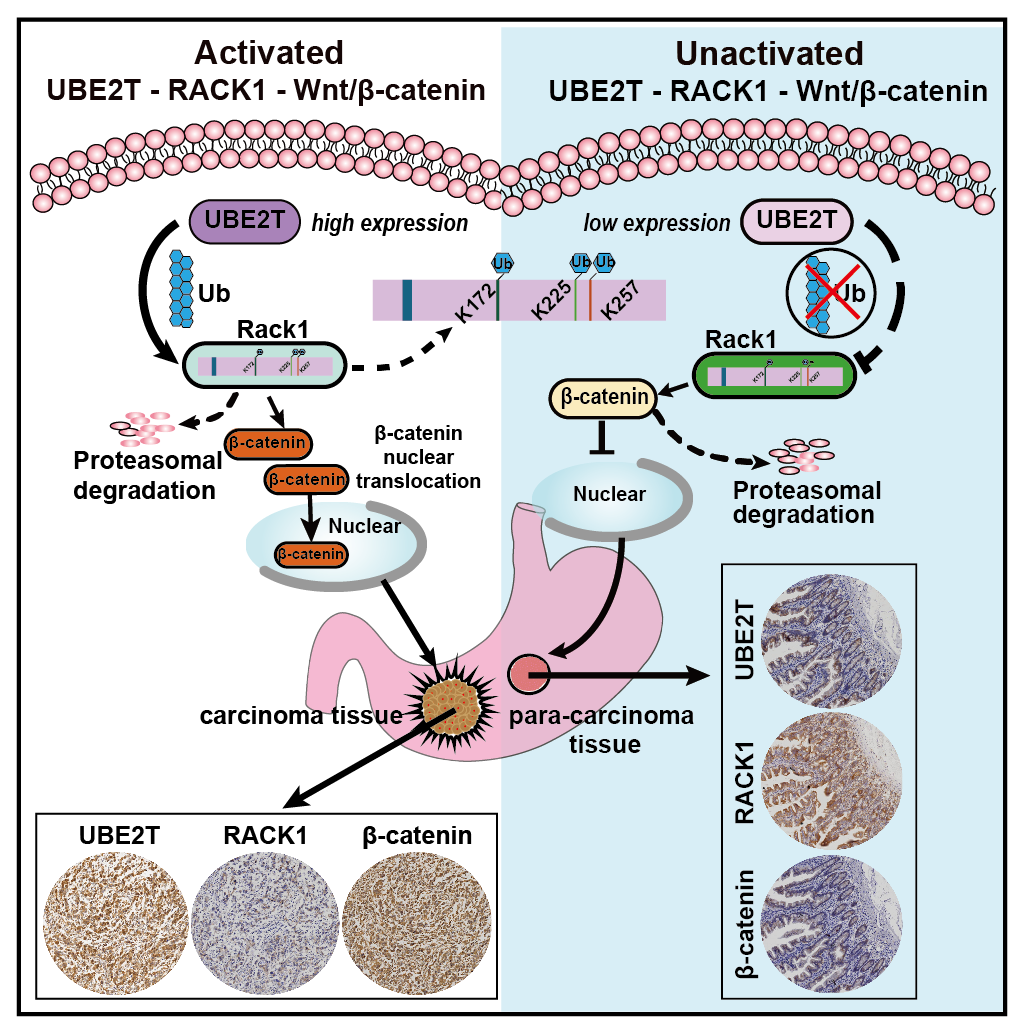
圖2. 這項研究闡明了β-catenin破壞復(fù)合體關(guān)鍵蛋白RACK1在胃癌中被上游的泛素化結(jié)合酶UBE2T降解的分子機制,并靶向UBE2T開發(fā)了低細(xì)胞毒性的小分子抑制劑,可在體內(nèi)外抑制胃癌的進(jìn)展(Yu?et?al.?Oncogene)。
?